Versorgungsengpass bei parenteralen Calcium-Präparaten
Gemäss Angabe des Zulassungsinhabers wurde Calcium-Sandoz Injektionslösung ab Anfang November 2015 aus dem Handel genommen.
Die Ursache dieses Produktionsstopps liegt bei der fehlenden Verfügbarkeit eines zertifizierten Wirkstoffs. Aus diesem Grund ist es der Firma Sandoz Pharmaceuticals AG nicht mehr möglich, dieses Produkt weiterhin herzustellen.
Da es sich jedoch um ein essenzielles Produkt im Spitalwesen handelt, hat das Bundesamt für Wirtschaftliche Landesversorgung (BWL) die Situation mit diversen involvierten Partnern diskutiert.
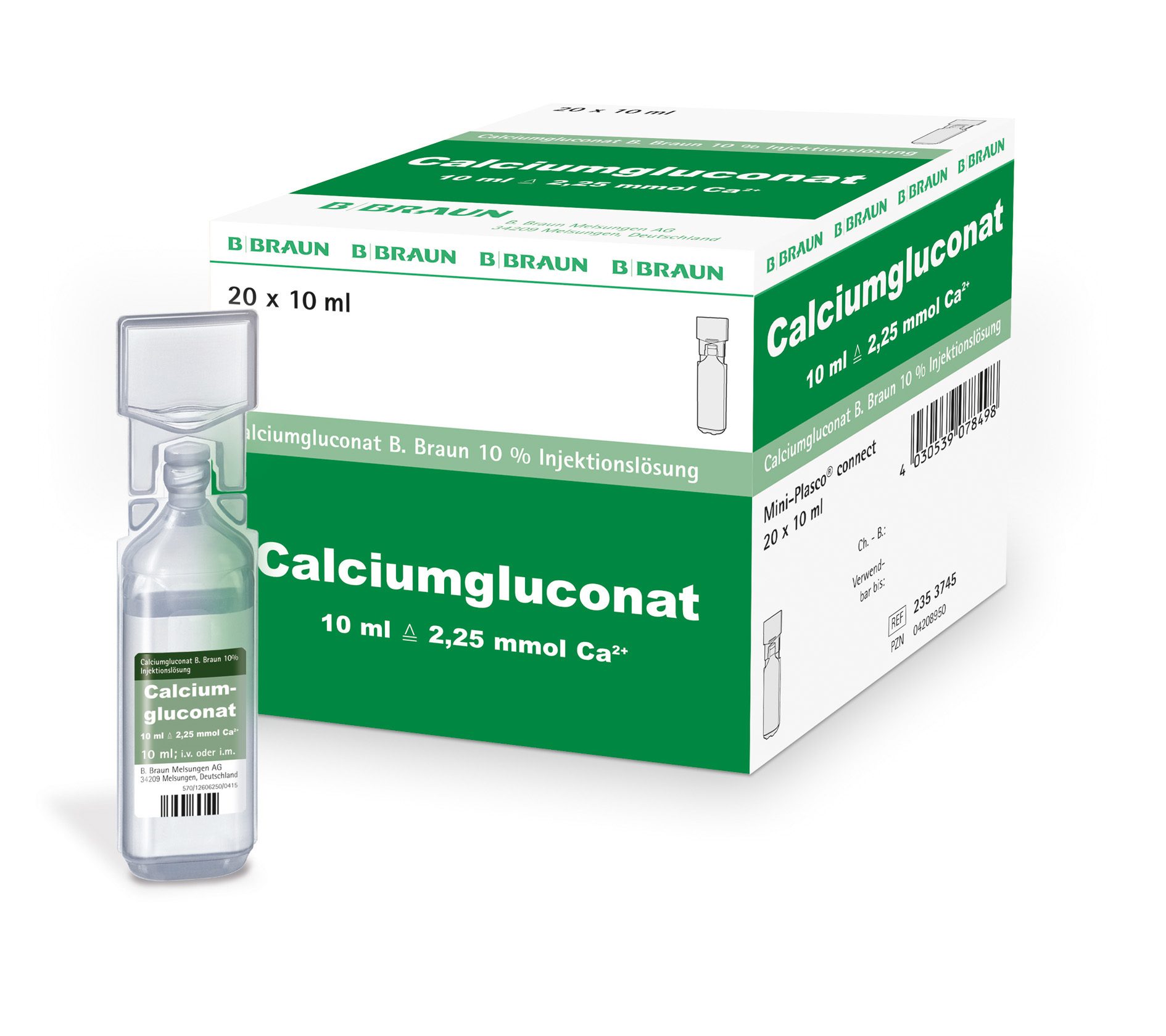
Verschiedene Anbieter, u.a. B. Braun Medical AG, verfügen im benachbarten europäischen Ausland über eine Zulassung für parenterale Calcium-Präparate. In beschränktem Ausmass wären sie in der Lage, Ware dem Schweizer Markt zur Verfügung zu stellen. Im Fall der Firma B. Braun Medical AG handelt es sich um Calcium-Gluconat und nicht, wie beim Produkt der Firma Sandoz, um Calcium-Glubionat.
Mitteilung des BWL
Mögliches Vorgehen für den Import von Calciumgluconat 10% B. Braun (Artikelnummer 2353745)
Es besteht die Möglichkeit, die Firma B. Braun Medical AG mittels untenstehendem Vertrag zu einem Import gemäss den „Rechtlichen Grundlagen“ (siehe unten) zu ermächtigen.
Drucken Sie den Importvertrag im Doppel aus und füllen Sie alle benötigen Felder aus. Unterschreiben Sie beide Kopien und schicken Sie diese per Post an:
B. Braun Medical AG
Qualitätsmanagement Vertrieb
Seesatz 17
6204 Sempach
Sie können uns den unterschriebenen Vertrag auch eingescannt senden an: freigabe.ch@bbraun.com
In jedem Fall brauchen wir ein Doppel der unterschriebenen Verträge, wovon wir Ihnen ein Exemplar wieder retournieren werden.
Sobald der von Ihnen unterzeichnete Importvertrag und Ihre Bestellung bei uns eingegangen sind, können wir den Import von Calciumgluconat 10% starten. Im Normalfall ist das Produkt innerhalb von drei Wochen verfügbar.
Zugehörige Dokumente
Rechtliche Grundlagen B. Braun Medical AG Schweiz möchte im oben genannten Zusammenhang Folgendes festhalten: Verantwortlichkeiten von B. Braun Medical AG (Grosshandelsfirma) B. Braun Medical AG muss nach dem geltenden Recht mindestens Folgendes prüfen: A Die Berechtigung der bestellenden Medizinalperson zum Import nach Art. 49 Absatz 3 AMBV. - Hat der Kunde (Apotheker/in) in der Spitalapotheke die pharmazeutische Verantwortung? B Das Arzneimittel ist von einem Land mit vergleichbarer Arzneimittelkontrolle zugelassen, (gemäss „HD-Verzeichnis Liste Länder mit anerkanntem GMP Kontrollsystem“, Swissmedic). C Die „Befugnis für die Einfuhr von Calciumgluconat“ liegt beidseitig unterschrieben vor. D Eine konkrete Kundenbestellung ist vorhanden E Es handelt sich um klein Mengen Verantwortlichkeiten Medizinalperson Die bewilligte Medizinalperson muss: A Apotheker sein, der in der Spitalapotheke die pharmazeutische Verantwortung innehat. B Sicherstellen, dass die gesetzlichen Bedingungen Art. 49 AMBV Absatz 3 erfüllt sind: - das Arzneimittel ist für einen namentlich benannten Patienten oder für Notfälle bestimmt - das Arzneimittel von einem Land mit vergleichbarer Arzneimittelkontrolle zugelassen ist Für das betroffene Arzneimittel ist entweder: - In der Schweiz kein alternativ einsetzbares Arzneimittel zugelassen (oder verfügbar) oder - eine Umstellung der Medikation nicht angemessen - Buch führen über den patientenbezogenen Einsatz des Produktes |
Andererseits besteht die Möglichkeit, das Produkt über eine Internationale Apotheke zu beziehen.